遅発性ジスキネジア対策の服用状況(7月4日現在)はこちら ※ミトコンドリア機能低下との関連性についても
7月12日加筆しました
ご報告です!
6月中旬からウルソデオキシコール酸(熊の胆汁酸TUDCAの主成分を合成した物質)とタウリンの同時摂取でジスキネジアの症状(口もぐもぐ)と口腔異常感を止めることに成功しました!
四六時中、口に意識が集中してしまい、何をやっていても集中力に欠け中途半端。
それが今はやっと口を気にすることなく生活ができるようになりました。
ユビキノール(還元型コエンザイムQ10)の大量摂取でもジスキネジア(口をもぐもぐ)は止めることができていましたが、
ユビキノールの大量摂取よりUDCAの方が、口腔内の異常感にもよく効いてます。
よりスッキリはっきり止まります!
このまま飲み続ければやがて根治か?と思うほどの予感もあります!
そこで、私の他にもSNSで知り合ったジスキネジアをもつ男性にもウルソ(UDCAの略)やタウリンを試してもらったところ(6月23日頃から開始)
【A氏の場合】
その方(仮にA氏)はウルソを150mg飲んですぐ「食いしばり(ジスキネジアの症状の一種)」がなくなったそうです。
そして7月11日、ウルソを300mgに増量してみたところ、食いしばり、口もぐもぐ両方の症状が止まったと連絡ありました。
A氏は他に薬剤性パーキソニズムと思われる手の震えという症状もあるのですが、手の震えに関しても「ちょっと楽になった」と言ってました。
ウルソデオキシコール酸でジスキネジアの症状を止めることができたのは、私とA氏で2例目です。
ちなみにA氏は現在「ウルソ」「タウリン」「ユビキノール」の服用です。
私は今まで様々な文献を読み漁ってきましたが、今回数々の点と点が線となりました。
ウルソとタウリンは遅発性ジスキネジアにダイレクトに効く組み合わせということを確認できました。
当初はウルソ単剤で試し症状は止まりましたが、タウリンを同時摂取することでより効果が高いことも実感。
ジスキネジアとともに長年口腔に違和感も感じておりましたがそれもスッキリ!
ちなみに私の口腔異常感は主に「唇や舌の痺れるような感覚」「神経のない歯の痛み」「歯や歯茎が浮いているようなむずむずした感覚」「舌で歯の裏側を無意識にこする」
これもウルソとタウリンでスッキリしてます!
現在もサプリは沢山飲んでいますが、ジスキネジアは体の栄養状態の底上げがあればウルソとタウリンだけでも止まると思います。
出来ればセットとして私がお勧めしているミトコンドリアサポートセットも追加で飲んでいただきたいです。
///////////ジスキネジア対策 ウルソデオキシコール酸(インド製) 1錠300mg タナベ胃腸薬ウルソ 1錠50mg タウリン 飲み方 ウルソとタウリンを一緒にぬるま湯とともに服用 【私の場合】 最初の1週間のUDCA量 1回300mgを1日3回~4回 7月6日までUDCA量 1回150mg1日3回~4回 7月7日からタナベ胃腸薬ウルソ 1回50mg~150mgに適時調整してみたが効いている
///////////ミトコンドリアサポートセット ユビキノール(還元型コエンザイムQ10) アセチル・L-カルニチン&アルファリポ酸 ビタミンC ビタミンE(処方薬名ユベラN) ビタミンB群(処方薬名ビタノイリン)
それでは数々の点を紹介
1)タウリンとミトコンドリア病とTUDCA
タウリンとミトコンドリア病について以前まるのブログでも書きました
http://bzd-phytotoxicity.org/?p=239
上記ブログ内で紹介している熊本大学の研究にTUDCAの記述があります
https://www.jst.go.jp/pr/announce/20180110/index.html
抜粋
MELASやMERRFなどタウリンの機能低下によるミトコンドリア病に対する治療薬の開発につながります。細胞やモデル動物で有効性が示されたTUDCAは、イタリアなどヨーロッパで肝疾患の治療薬として使用されており、医薬品としての安全性が確かめられています。今後は、TUDCAがMELASやMERRFなどのミトコンドリア病の治療薬となるかを調べるための臨床研究を実施することを計画しています。
また、MELASやMERRF以外のミトコンドリア病やさまざまな疾患においても、タウリンの働きが二次的に低下するという同様な分子機構で発症する可能性が考えられます。今後は、ミトコンドリア機能低下を示すさまざまな疾患についてもタウリンの働きを調べ、TUDCAの効果を検討していきたいと考えています。
2)動物胆系生薬「牛黄(ゴオウ)」
処方せん薬局にてサンプルとしていただいたドリンク剤「若甦(牛黄入)」でジスキネジア が止まる経験をする
しばらく続けましたが、1本600円もすることから継続を断念
牛黄は牛の胆石です
牛黄と熊胆(TUDCA)、、ともに胆汁酸が鍵か?
と思い始めたキッカケ
3)ウルソデオキシコール酸がパーキンソン病やレビー小体型認知症に効く可能性
http://kunota506.com/2015/08/19/post-4532/
肝臓の薬がパーキンソン病の進行を遅らせる可能性を示す結果が報告された。
研究者らは、肝臓病治療薬であるウルソデオキシコール酸(UDCA)がパーキンソン病に関連するLRRK2遺伝子変異に働く可能性を見出した。
研究者らはUDCAが症状の有無に関わらず、LRRK2変異を持つドーパミン神経細胞のミトコンドリア機能を改善することを示した。
さらに、LRRK2変異を持つショウジョウバエにUDCAを飲ませると、神経細胞の変性による視機能の低下が遅れることを明らかにした。
ミトコンドリア機能の低下は、LRRK2変異を持たないパーキンソン病患者の細胞でも認められるため、研究者らはUDCAが他のタイプのパーキンソン病やその他の神経変性疾患にも効果があることを期待している。
RRK2は脳全体に分布しており、レビー小体型認知症との関連も示唆されています。ウルソデオキシコール酸は「ウルソ®」として古くから肝機能障害に広く使われている安価な薬です。製薬会社が乗り気になるかどうかわかりませんが、臨床試験の結果が待ち遠しいです。
ここまで書いて気がついたのですが、2013年にもウルソデオキシコール酸がミトコンドリア機能の改善を介してパーキンソン病に効果があるのでは?という以下の記事がありました。やはり、儲かる可能性がないと臨床試験はされないか?
パーキンソン病の有望な薬、ウルソデオキシコール酸の研究
https://blog.goo.ne.jp/news-t/e/d767e31c42120fa516d441dc31ab0e33
4)脳局在型胆汁酸トランスポーターSLC10A4の機能解析
https://t.co/49IBQ00jSX?amp=1
抜粋
胆汁酸の細胞毒性は疎水性が高いほど高く、親水性が高いほ ど低くなる傾向がある。
TCA はタウリン抱合型であるため親水性胆汁酸に分類されるが、さらに親水性の高いtauroursodeoxycholic acid (TUDCA)は神経保護作用を持つことが報告されている。
神経保護作用を持つ親水性胆汁酸として他にUDCAが挙げられる。
したがって、トロンビン処置によ り TUDCA や UDCA の輸送能が亢進するならば、神経保護の目的に効果を示す可能性が考えられる。
本研究において、TUDCA および UDCA の取り込み能は 評価しなかったが、今後これらの取り込み能について検討が必要と考える。
5)古くて新しい胆汁酸の研究(脳の胆汁酸に言及) という東北大教授のコラム
https://t.co/vBFjiJovwO?amp=1
抜粋
脳の中にも胆汁酸がある
胆汁酸は蛋白質溶解作用(これをデタージェント作用という)を持っており、神経の軸策を溶かしてしまうということもわかっています。このため、これまでは脳内には存在しないと考えられてきました。
しかし、私たちは従来とは異なる新しい測定法を作り検索したところ、ケノデオキシコール酸が結構多量に存在し、しかもある種の蛋白質(まだ構造は明らかになっていません)と、大変強固に結合した状態で存在することがわかりました。
さらに調べてみると、脳内で活性は弱いもののこの胆汁酸を生合成する酵素系が存在すること、また脳内のある特定の組織に胆汁酸に特異的なトランスポーターが存在していることもわかってきました。この組織はパーキンソン病発症と深く関わっていることから、今後、脳内における胆汁酸の役割を解明し、病気との関係、さらには適切な医薬品の創製に役立てるつもりです
6)ALSとタウロウルソデオキシコール酸
http://www.miguchi.net/archives/7147
当事者ブログから抜粋
筋萎縮性側索硬化症 (ALS) の新規治療薬 Tauroursodeoxycholic acid (タウロウルソデオキシコール酸, TUDCA) のパイロット研究の結果が、European Journal of Neurology誌に掲載されました (2015年2月9日 published online)。
ウルソデオキシコール酸 (商品名 ウルソ) は胆汁うっ滞、肝機能障害の治療で良く用いますが、タウロ・ウルソデオキシコール酸の名前は初めて聞きました。肝臓で産生される親水性の胆汁酸で、脂肪肝の治療に用いられる薬剤なのだそうです。
細胞保護や抗アポトーシス作用があるそうです。
National Center for Biotechnology Information(国立生物工学情報センター)
https://www.ncbi.nlm.nih.gov/pubmed/25664595
リルゾールを内服中の 34名の ALS患者に、TCDUAないしは プラセボを上乗せした。3ヶ月後に評価し、一次アウトカムは ALSFRS-Rスコアのスロープの 15%以上改善、二次アウトカムは群間比較 (ALSFRS-Rスコア、ALSFRS-Rスコアの線形回帰スロープ、有害事象) とした。
両群間の有害事象に差はなく、効果があったのは、TUDCA 87%, プラセボ 43% (P=0.021) だった。
ベースラインを調整した試験終了時の ALSFRS-Rは、TUDCA群で有意に高かった (p=0.007)。
線形回帰スロープでは、TUDCA群の方が有意に進行が遅かった (P<0.01)。
7)アルハカさんからの問いかけ
アルツハッカー alzhacker
http://alzhacker.com/
私は栄養療法を自分なりに実践してきました
当初はオーソモレキュラーや三石理論や藤川徳美先生を参考にしてましたが
一番参考にしているのはリコード法を日本でいち早く紹介したアルハカさんのブログです
アルハカさんから紹介された情報
ウルソデオキシコール酸
UCB(高レベルの非抱合型ビリルビン)によって誘発されるアポトーシス細胞死を減少させた
サイトカイン放出を無効にした
UCB誘発バリア透過性を無効にした
8)タウリンについて(7月5日加筆)
牡蠣小屋で牡蠣を20〜30個食べたことがあり、その時ジスキネジア症状が止まってビックリした経験(大量のタウリンで症状が止まったと思われました)
ジスキネジアはもしかするとミトコンドリアの機能低下で起こるのではないかと疑っていたこともあり、川崎医科大学が行っていた医師主導の治験を模倣することに
難病指定のミトコンドリア病MELAS(ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群)へのタウリン大量摂取療法
内容は、タウリン1回4gを 1日3回(合計12g)の摂取でしたが、実際は1日15gくらいまで飲んでみました(現在は保険適用)
確かにジスキネジアは止まりましたが、ものすごく眠くなり生活に支障をきたすほど
結局断念し他の方法を探し始める
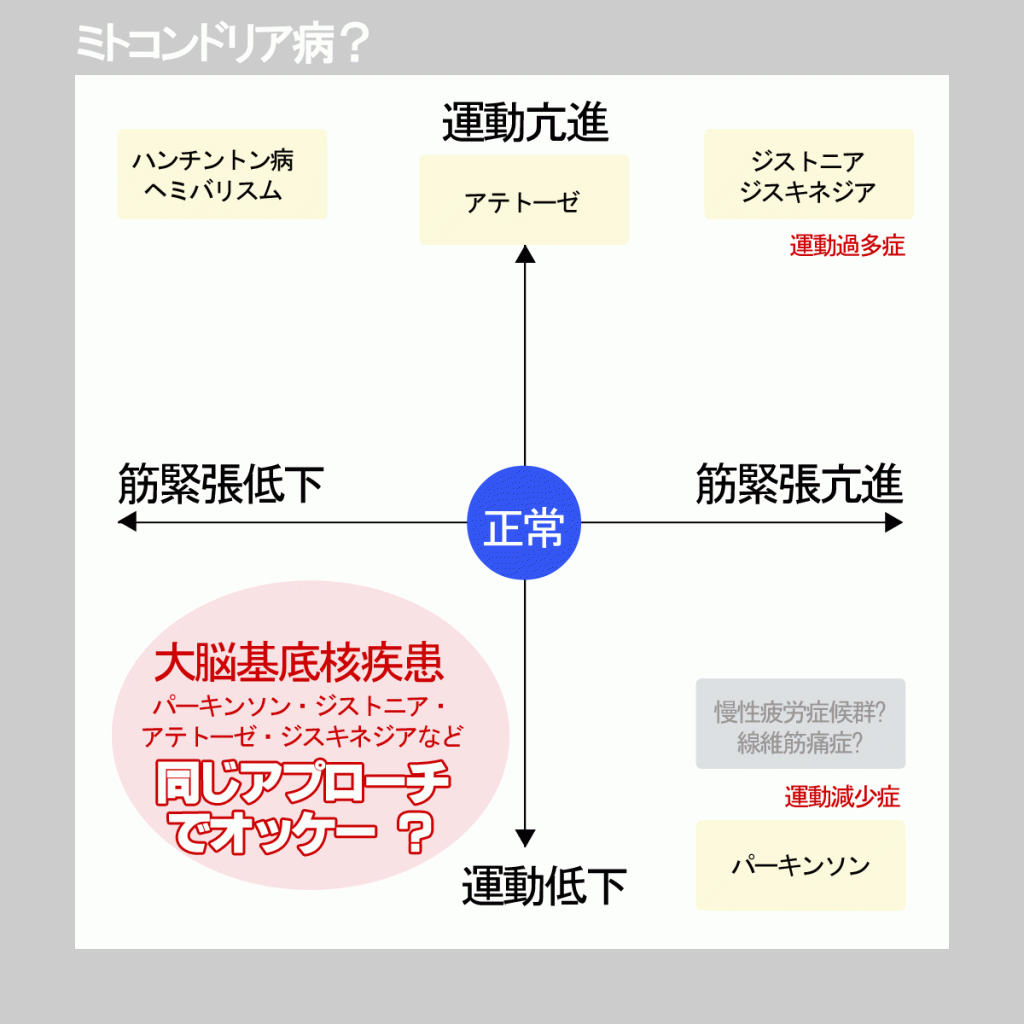
※ミトコンドリア脳筋症(ミトコンドリア病)について
https://medical.jiji.com/medical/011-0072-01
以上、取り急ぎご報告でした!